高中化学知识点总结(800字精选范文10篇)

化学反应与能量
- 吸热反应与放热反应:根据反应过程中能量的变化判断。
- 焓变:化学反应过程中能量变化的度量,放热反应焓变为负值,吸热反应焓变为正值。
- 盖斯定律:反应焓变只与始态和终态有关,与反应途径无关。
化学反应速率与化学平衡
- 化学反应速率:单位时间内反应物浓度的减少或生成物浓度的增加。
- 影响因素:浓度、温度、压强、催化剂等。
- 化学平衡:可逆反应中,正逆反应速率相等,各组分浓度保持不变的状态。
- 平衡移动原理:改变条件,平衡向减弱这种改变的方向移动。
元素周期律与元素周期表
- 原子结构:核外电子排布规律,决定元素的化学性质。
- 元素周期律:元素的性质随着原子序数的递增呈周期性变化。
- 元素周期表:元素周期律的具体表现形式,同一周期,从左到右,金属性减弱,非金属性增强;同一主族,从上到下,金属性增强,非金属性减弱。
重要的无机物及其应用
- 钠及其化合物:过氧化钠与二氧化碳、水的反应,碳酸钠与碳酸氢钠的性质比较。
- 铝及其化合物:铝的两性,氢氧化铝的两性。
- 铁及其化合物:二价铁与三价铁的相互转化。
- 氯及其化合物:氯气的制备,次氯酸的漂白性。
- 硫及其化合物:二氧化硫的漂白性,浓硫酸的强氧化性。
- 氮及其化合物:氨气的催化氧化,硝酸的强氧化性。
化学键与物质的结构
- 离子键:阴阳离子通过静电作用形成的化学键。
- 共价键:原子间通过共用电子对形成的化学键。
- 金属键:金属原子与自由电子之间的相互作用。
- 分子间作用力:分子间存在的较弱的相互作用。
- 氢键:特殊的分子间作用力,影响物质的熔沸点。
有机化学基础
- 同系物:结构相似,分子组成相差一个或若干个CH2原子团的物质。
- 同分异构体:分子式相同,结构不同的化合物。
- 烷烃:通式CnH2n+2,主要反应为取代反应。
- 烯烃:通式CnH2n,含有碳碳双键,可发生加成、加聚反应。
- 炔烃:通式CnH2n-2,含有碳碳叁键,可发生加成、加聚反应。
- 苯:典型芳香烃,可发生取代、加成反应。
- 醇:含有羟基,可发生取代、消去、氧化反应。
- 醛:含有醛基,可发生加成、氧化反应。
- 羧酸:含有羧基,具有酸性,可发生酯化反应。
- 酯:酯化反应的产物,可发生水解反应。
化学实验基础
- 仪器的使用:熟悉常见仪器的名称、用途和使用方法。
- 基本操作:掌握药品的取用、加热、过滤、蒸发、蒸馏等基本操作。
- 物质的分离与提纯:根据物质性质的差异,选择合适的方法进行分离和提纯。
- 物质的检验:掌握常见离子、物质的特征反应和检验方法。
化学计算
- 物质的量:联系宏观与微观的桥梁,单位为摩尔(mol)。
- 摩尔质量:单位物质的量的物质所具有的质量,单位为g/mol。
- 阿伏伽德罗常数:1mol任何物质所含有的粒子数,约为6.02×10^23。
- 气体摩尔体积:标准状况下,1mol任何气体所占的体积约为22.4L。
- 物质的量浓度:单位体积溶液中所含溶质的物质的量,单位为mol/L。
电解质溶液
- 电离平衡:弱电解质在溶液中部分电离达到平衡状态。
- 水的电离:水是一种极弱的电解质,存在电离平衡。
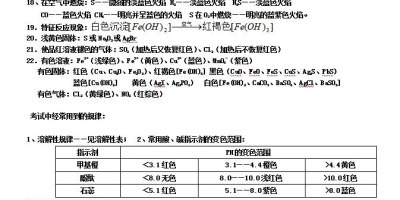
- 溶液的pH:表示溶液酸碱性强弱的物理量,pH=-lg[H+]。
- 盐类水解:盐的离子与水电离出的H+或OH-结合生成弱电解质的反应。
氧化还原反应
- 氧化还原反应的本质:电子的转移或偏移。
- 氧化剂与还原剂:在氧化还原反应中,得电子的物质是氧化剂,失电子的物质是还原剂。
- 氧化数:用来表示元素在化合物中化合价的一种形式。
- 常见的氧化剂:活泼的非金属单质、高价态的含氧酸盐等。
- 常见的还原剂:活泼的金属单质、低价态的化合物等。